Các dạng bài tập về Nhôm và các hợp chất của Al như Nhôm Oxit Al2O3, Nhôm hidroxit Al(OH)3 luôn gây bối rối cho nhiều bạn, vì Al có tính chất hóa học đặc trưng đó là kim loại lưỡng tính.
Bạn đang xem: Công thức tính nhanh bài tập nhôm
Để giúp các em hiểu rõ tính lưỡng tính của nhôm (Al vừa phản ứng được với bazo vừa phản ứng được với axit), và dễ dàng giải các dạng bài tập về Nhôm cùng các hỗn hợp và hợp chất của nhôm như Nhôm Oxit, Nhôm Hidroxit sẽ là nội dung của bài viết này.
I. Kiến thức cần nhớ về Nhôm Al
* Tính chất hóa học của Nhôm Al
♦ Nhôm tác dụng với Phi kim
♦ Nhôm tác dụng với nước
♦ Nhôm tác dụng với oxit của kim loại kém hoạt động hơn
♦ Nhôm tác dụng với dung dịch axit
♦ Nhôm tác dụng với dung dịch bazơ
♦ Nhôm tác dụng với dung dịch muối
- Về chi tiết các phản ứng hoá học của Nhôm với các chất và dung dịch ở trên, nếu các em chưa nhớ có thể xem lại bài học về nhôm: Tính chất hóa học của Nhôm Al và các hợp chất.
- Bài viết này chỉ tóm lược lại một số tính chất hoá học của nhôm và hợp chất:
1. Nhôm Oxit Al2O3 và Nhôm Hidroxit Al(OH)3 là những chất lưỡng tính
a) Tác dụng với axit
Al2O3 + 6HCl → 2AlCl3 + 3H2O
PT ion: Al2O3 + 6H+ → 2Al3+ + H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
PT ion: Al(OH)3 + 3H+ → Al3+ + 3H2O
- Ở trên chúng ta viết phương trình phản ứng dạng phân tử và phương trình dạng ion, nếu các em chưa hiểu rõ cách viết phương trình ion thu gon ở trên, có thể xem lại nội dung này ở bài học: Phản ứng trao đổi ion trong dung dịch các chất điện ly
b) Tác dụng với bazơ
Al2O3 + 2OH- + 3H2O → 2
hoặc: Al2O3 + 2OH- → 2AlO2- + H2O
Al(OH)3 + OH- →
hoặc: Al(OH)3 + OH- → AlO2- + 2H2O
2. Phản ứng của Nhôm với dung dịch kiềm
- Về nguyên tắc, Al dễ dàng đẩy Hidro ra khỏi nước, nhưng trong thực tế có màng Oxit bảo vệ nên vật bằng nhôm không tác dụng với nước khi nguội và đun nóng (ở nhiệt độ nhất định).
- Tuy nhiên những vật bằng nhôm này bị hoà tan trong dung dịch kiềm như NaOH, Ca(OH)2,... điều này xảy ra vì có các phản ứng sau:
- Đầu tiên, màng oxit bị phá huỷ trong dung dịch kiềm:
Al2O3 + 2NaOH + 3H2O → 2Na
hoặc: Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Tiếp đến kim loại nhôm khử nước:
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑ (2)
- Màng Al(OH)3 bị phá huỷ trong dung dịch bazơ
Al(OH)3 + NaOH → Na
hoặc: Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Các phản ứng (2) và (3) xảy ra luân phiên cho tới khi Al bị tan hết, vì vậy có thể viết gộp lại:
2Al + 2NaOH + 6H2O → 2Na
hoặc: 2Al + 2NaOH + 6H2O → 2NaAlO2 + 3H2↑
3. Muối nhôm tác dụng với dung dịch kiềm
- Hiện tượng quan sát được khi nhỏ từ từ dung dịch bazo vào dung dịch Al3+ : ban đầu xuất hiện kết tủa keo trắng, kết tủa tăng đến cực đại sau tan dần đến hết tạo dung dịch trong suốt.
Al3+ + 3OH- → Al(OH)3↓
Nếu OH- dư: Al(OH)3↓ + OH- →
- Tuy nhiên Al(OH)3 có tính axit rất yếu nên dễ bị axit mạnh đẩy ra khỏi muối
Khi H+ dư: Al(OH)3↓ + H+ → Al3+ + H2O
- Hiện tượng quan sát được khi nhỏ từ từ dung dịch H+ đến dư và dung dịch AlO2- là ban đầu thấy xuất hiện kết tủa keo trắng, kết tủa tăng đến cực đại và sau tan dần đến hết tạo dung dịch trong suốt.
- Al(OH)3 có tính axit yếu hơn cả axit H2CO3 nên khi sục khí CO2 vào dung dịch NaAlO2 thì xảy ra phản ứng:
NaAlO2 + CO2 + H2O → Al(OH)3↓ + NaHCO3
- Hiện tượng quan sát được khi sục khí CO2 vào đến dư vào dung dịch AlO2- thấy có xuất hiện kết tủa keo trắng.
II. Một số lưu ý khi giải bài tập về Nhôm, hỗn hợp nhôm và các hợp chất của nhôm.
- Với các bài toán hóa học về nhôm, hợp chất của nhôm cũng như các bài toán hỗn hợp. Ngoài việc sử dụng các phương pháp như bào toàn khối lượng (số mol từng nguyên tố trước và sau không đổi) , bảo toàn electron, tăng - giảm khối lượng,...
- Khi giải các bài tập về các oxit lưỡng tính như: Al2O3, ZnO, Cr2O3,... hay các hiđroxit lưỡng tính như: Al(OH)3, Zn(OH)2, Pb(OH)2, Cr(OH)3, ... các muối axit (của axit yếu): NaHCO3, Na2HPO4,... các muối amoni của axit yếu như: (NH4)2CO3, CH3COONH4,... cần lưu ý:
- Một chất lưỡng tính thì tác dụng được với đồng thời cả axit và bazơ (ngược lại chưa chắc đúng).
* Ví dụ: Al(OH)3 là chất lưỡng tính nên
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Na2CO3 vừa tác dụng với axit, vừa tác dụng với bazơ nhưng Na2CO3 không phải là chất lưỡng tính:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Na2CO3 + Ba(OH)2 → BaCO3↓ trắng + 2NaOH
- Tính chất của muối NaAlO2 (Natri aluminat) và Na2ZnO2 (Natri zincat)
- Các muối NaAlO2 và Na2ZnO2 là các muối của axit yếu Al(OH)3 và Zn(OH)2. Do đó dung dịch các muối này có môi trường bazơ mạnh. Khi thêm axit mạnh vào dung dịch các muối này sẽ xuất hiện kết tủa do axit mạnh đẩy axit yếu là Al(OH)3 và Zn(OH)2 ra khỏi muối và tạo thành kết tủa.
* Ví dụ: NaAlO2 + HCl + H2O → NaCl + Al(OH)3↓
Nếu dư HCl thì: Al(OH)3↓ + 3HCl → AlCl3 + 3H2O
* Ví dụ 2: NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
* Các phản ứng của Zn(OH)2, Na2ZnO2 hoàn toàn tương tự như của Al(OH)3 và NaAlO2
- Lưu ý: Các kim loại, oxit kim loại kiềm và kiềm thổ (trừ Be và Mg) tác dụng với H2O tạo ra các dung dịch bazơ kiềm. Do đó cần lưu ý, khi cho kim loại kiềm, kiềm thổ hoặc oxit của chúng (ví dụ Na) vào dung dịch chứa Al3+, Zn2+ ,... thì:
2Na + 2H2O → 2Na+ + 2OH- + H2
Sau đó: Al3+ + 3OH- → Al(OH)3↓ và Al(OH)3 + OH- → AlO2- + 2H2O
1) Những lưu ý khi giải bài tập về phản ứng nhiệt nhôm:
+ Nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch kiềm → H2 thì Al còn dư sau phản ứng nhiệt nhôm hoặc hiệu suất H của phản ứng 2) Những lưu ý khi giải bài tập về nhôm khi phản ứng với dd bazo kiềm
* Cơ chế phản ứng:
+ Trước tiên, Al tham gia phản ứng với nước:
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
+ Al(OH)3 sinh ra là hiđroxit lưỡng tính tan được trong dung dịch kiềm:
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Quá trình này lặp đi lặp lại đến hết.
* Đặc biệt chú ý: Nếu cho hỗn hợp Na, K, Ba, Ca và Al (hoặc Zn) vào nước dư, xảy ra các phản ứng:
2M + 2H2O → 2MOH + H2↑
MOH + H2O + Al → MAlO2 + 3⁄2H2↑
+ Trong quá trình giải toán có 2 trường hợp xảy ra:
◊ Trường hợp 1: Cả kim loại kiềm và Al đều phản ứng hết nếu số mol kim loại kiềm ≥ số mol Al.
◊ Trường hợp 2: Kim loại kiềm phản ứng hết, Al dư nếu số mol kim loại kiềm III. Một số dạng bài tập về Nhôm và Phương pháp giải
1) Dạng 1: Muối Al3+ tác dụng với dung dịch OH-
Al3+ + 3OH- → Al(OH)3↓ (4)
Khi OH- dư: Al(OH)3 + OH- →
⇒ Al3+ + 4OH- →
a) Bài toán 1: Cho biết số mol của Al3+ và OH- yêu cầu tính lượng kết tủa.
* Phương pháp giải:
+) Cách giải 1: Tính toán dựa theo phương trình phản ứng
- Viết PTPƯ: Al3+ + OH- → Al(OH)3↓
- Tính toán số mol theo PTPƯ xem Al3+ dư hay OH- dư, nếu OH- dư ta có PTPƯ hoà tan 1 phần hoặc hết Al(OH)3 như sau:
Al(OH)3 + OH- →
- Dựa theo PTPƯ, tính toán số mol Al(OH)3 bị hoà tan theo số mol OH- dư.
+) Cách giải 2: Lập tỉ lệ số mol để biết cơ chế phản ứng
- Đặt:
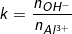
• Xét các trường hợp sau:
◊ Nếu k ≤ 3: Chỉ xảy ra phản ứng (4), chỉ tạo Al(OH)3↓ (Al3+ dư nếu k- thì:
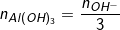
◊ Nếu 33↓ và
- Khi đó: Gọi số mol Al(OH)3 là x mol, 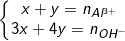
◊ Nếu k≥4: Chỉ xảy ra phản ứng (5), chỉ tạ ra
- Khi đó:
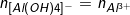
Ví dụ 1: Cho 700 ml dung dịch KOH 0,1M vào 100 ml dung dịch AlCl3 0,2M. Sau phản ứng khối lượng kết tủa tạo ra là:
* Lời giải:
+) Áp dụng cách giải 1:
- Theo bài ra ta có: nKOH = 0,7.0,1 = 0,07 (mol); nAlCl3 = 0,1.0,2 = 0,02 (mol).
- Ta có PTPƯ:
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Ban đầu: 0,02 0,07 mol
Phản ứng: 0,02 0,06 0,02 0,06
Sau PƯ: 0 0,01 0,02 0,06
- Vì vậy KOH còn dư nên ta có phản ứng:
Al(OH)3 + KOH → K
Ban đầu: 0,02 0,01
Phản ứng: 0,01 ← 0,01
Sau PƯ: 0,01 0 0,01
- Vậy sau khi xảy ra phản ứng hoàn toàn, ta có: nK
⇒ mAl(OH)3 = 0,01.78 = 0,78 (g).
+) Áp dụng cách giải 2:
- Theo bài ra, ta có: nOH- = 0,07 (mol); nAl3+ = 0,02 (mol)
- Ta lập tỉ lệ:
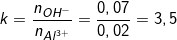
- Ta thấy: 33 và
- Gọi số mol của Al(OH)3 và
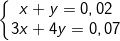
⇒ nAl(OH)3 = 0,01 (mol) ⇒ mAl(OH)3 = 0,01.78 = 0,78 (g).
* Nhận xét: Trong 2 cách giải trên, cách giải 1 thực hiện lần lượt việc so sánh số mol theo các PTPƯ để biết chất nào pư hết, chất nào còn dư. Còn cách giải 2 thực hiện việc lập tỉ lệ số mol và so sánh ngay trước khi giải nên nắm được tổng quát bài toán. Như vậy cách giải 2 tỏ ra tốt hơn cách giải 1.
Ví dụ 2: Rót 100ml dung dịch NaOH 3,5M vào 100ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
* Lời giải:
+) Áp dụng cách giải 1:
- Ta có: Vdd NaOH = 100ml = 0,1 (lit) ⇒ nNaOH = CM.V = 3,5.0,1 = 0,35 (mol).
Vdd AlCl3 = 100ml = 0,1 (lit) ⇒ nAlCl3 = CM.V = 1.0,1 = 0,1 (mol).
- Ta có PTPƯ:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Ban đầu: 0,1 mol 0,35 mol
Phản ứng: 0,1 0,3 0,1 0,3
Sau PƯ: 0 0,05 0,1 0,3
- Theo PTPƯ ta thấy: 1 mol AlCl3 pư cần 3 mol NaOH ; như vậy theo bài ra có 0,1 mol AlCl3 pư cần 0,3 mol NaOH, nên số mol NaOH dư là: 0,35 - 0,3 = 0,05 (mol) ta có phản ứng sau:
Al(OH)3 + NaOH → Na
Ban đầu: 0,1 0,05
Phản ứng: 0,05 ← 0,05
Sau PƯ: 0,05 0 0,05
Vậy sau khi xảy ra phản ứng hoàn toàn, ta có: nNa
⇒ mAl(OH)3 = 0,05.78 = 3,9 (g).
+) Áp dụng cách giải 2:
- Theo bài ra, ta có: nOH- = 0,35 (mol); nAl3+ = 0,1 (mol)
- Ta lập tỉ lệ:
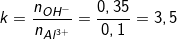
- 33 và
- Gọi số mol của Al(OH)3 và
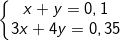
⇒ nAl(OH)3 = 0,05 (mol) ⇒ mAl(OH)3 = 0,05.78 = 3,9 (g).
Ví dụ 3: Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X, tính nồng độ mol/l các chất có trong dung dịch X.
* Lời giải:
- Theo bài ra: nOH- = 0,45.2 = 0,9 (mol);
nAl2(SO4)3 = 0,1.1 = 0,1 (mol) ⇒ nAl3+ = 2.nAl2(SO4)3 = 2.0,1 = 0,2 (mol).
- Ta có tỉ lệ:
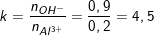
- Ta thấy: k>4 nên chỉ tạo
- Như vậy dung dịch X thu được gồm
- n
⇒ CM (K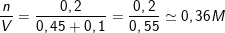
⇒ CM (NaOH) =
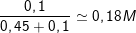
b) Bài toán 2: Cho biết số mol của 1 trong 2 chất phản ứng và số mol kết tủa, yêu cầu tính số mol của chất tham gia phản ứng còn lại.
* Loại 1: Cho biết số mol Al(OH)3 và số mol Al3+ tính số mol OH-
♦ Phương pháp giải:
- Nếu số mol Al(OH)3 = số mol Al3+ cả 2 chất phản ứng vừa đủ với nhau tạo Al(OH)3, khi đó nOH- = 3nAl(OH)3
- Nếu nAl(OH)3Al3+ thì có 2 trường hợp:
◊ Chưa có hiện tượng hoà tan kết tủa hay Al3+ còn dư, khi đó sản phẩm chỉ có Al(OH)3 và nOH- = 3nAl(OH)3
◊ Có hiện tượng hoà tan kết tủa hay Al3+ hết, khi đó sản phẩm gồm có Al(OH)3 và
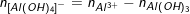
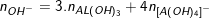
Ví dụ 1: Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lit của dung dịch NaOH biết các phản ứng xảy ra hoàn toàn.
* Lời giải:
- Theo bài ra, ta có: nAl2(SO4)3 = 0,3.0,2 = 0,06 (mol) ⇒ nAl3+ = 2.0,06 = 0,12 (mol).
- Cũng theo bài ra, nAl(OH)3 = 1,56/78 = 0,02 (mol).
- Ta thấy nAl(OH)3 Al3+ nên có 2 trường hợp xảy ra:
◊ Trường hợp 1: Al3+ dư nên chỉ tạo Al(OH)3 nên nOH- = 3.0,02 = 0,06 (mol).
⇒ CM (NaOH) = n/V = 0,06/0,5 = 0,12(M).
◊ Trường hợp 2: Al3+ hết tạo Al(OH)3 và
nAl(OH)3 = 0,02 (mol) ; n
⇒ nOH- = 3.0,02 + 4.0,1 = 0,46 (mol).
⇒ CM (NaOH) = n/V = 0,46/0,5 = 0,92(M).
Ví dụ 2: Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa, tính giá trị của V?
* Lời giải:
- Theo bài ra, ta có: nAl2(SO4)3 = 58,14/342 = 0,17 (mol) ⇒ nAl3+ = 2.0,17 = 0,34 (mol).
nAl(OH)3 = 23,4/78 = 0,3 (mol).
- Ta thấy: nAl(OH)3 Al3+ nên có 2 trường hợp xảy ra:
◊ Trường hợp 1: Al3+ dư nên chỉ tạo Al(OH)3 nên nOH- = 3.0,3 = 0,9 (mol).
⇒ V dd (NaOH) = n/CM = 0,9/0,4 = 2,25 (lít).
Xem thêm: Cách Khắc Phục Điện Thoại Bắt Được Wifi Nhưng Laptop Thì Không Vào Được
◊ Trường hợp 2: Al3+ hết tạo Al(OH)3 và
nAl(OH)3 = 0,3 (mol) ; n
⇒ nOH- = 3.0,3 + 4.0,04 = 1,06 (mol).
⇒ V dd (NaOH) = n/CM = 1,06/0,4 = 2,65 (lít).
* Loại 2: Biết số mol OH- số mol kết tủa Al(OH)3 tính số mol Al3+
• Phương pháp giải:
- So sánh số mol OH- của bài cho với số mol OH- kết tủa
- Nếu số mol OH- của bài cho lớn hơn với số mol OH- kết tủa thì đã có hiện tượng hòa tan kết tủa, sản phẩm khi đó có Al(OH)3 và
- Theo định luật bảo toàn:
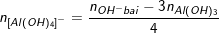
- Nếu trong bài có nhiều lần thêm OH- liên tiếp thì ta bỏ qua các giai đoạn trung gian, ta chỉ tính tổng số mol OH- qua các lần thêm vào rồi so sánh với lượng OH- trong kết tủa thu được ở lần cuối cùng của bài.
Ví dụ: Thêm 0,6 mol NaOH vào dung dịch chứa x mol AlCl3 thu được 0,2 mol Al(OH)3 Thêm tiếp 0,9 mol NaOH thấy số mol Al(OH)3 là 0,5. Tiếp tục thêm 1,2 mol NaOH nữa thấy số mol Al(OH)3 là 0,5. Tính x?
* Lời giải:
- Theo bài ra, ta có: ∑nOH- bài cho = 0,6 + 0,9 + 1,2 = 2,7 (mol).
- Số mol OH- trong kết tủa là: nOH- kết tủa =3.nAl(OH)3 = 3.0,5 = 1,5 (mol).
⇒ ∑nOH- bài cho > nOH- kết tủa ⇒ có tạo ra
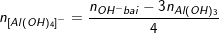
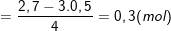
⇒
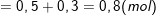
* Loại 3: Nếu cho cùng 1 loại Al3+ tác dụng với lượng OH- khác nhau mà lượng kết tủa không thay đổi hoặc thay đổi với lượng không tương ứng với sự thay đổi của OH- ví dụ như:
◊ TN1: a mol Al3+ tác dụng với b mol OH- tạo x mol kết tủa
◊ TN2: a mol Al3+ tác dụng với 3b mol OH- tạo ra x hay 2x mol kết tủa
Khi đó ta kết luận:
◊ TN1: Al3+ dư và OH- hết:
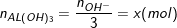
◊ TN2: Cả Al3+ và OH- đều hết và có hiện tượng hòa tan kết tủa:
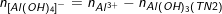
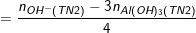
Ví dụ: TN1: Cho a mol Al2(SO4)3 tác dụng với 500ml dung dịch NaOH 1,2M được m (g) kết tủa.
TN2: Cũng cho a mol Al2(SO4)3 tác dụng với 750ml dung dịch NaOH 1,2M được m (g) kết tủa. Tính a và m?
* Lời giải:
- Vì lượng OH- ở 2 thí nghiệm khác nhau mà lượng kết tủa không thay đổi nên:
+) TN1: Al3+ dư và OH- hết, ta có: nOH- = 0,5.1,2 = 0,6 (mol).
⇒
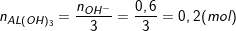
⇒ mAl(OH)3 = 0,2.78 = 15,6(g).
+) TN2: Cả Al3+ và OH- đều hết và có hiện tượng hòa tan kết tủa, ta có: nOH- = 0,75.1,2 = 0,9 (mol).
⇒ nAl(OH)3 = 0,2 (mol) ; n
⇒ ∑nAl3+ = 0,2 + 0,075 = 0,275(mol)
⇒ nAl2(SO4)3 = (∑nAl3+)/2 = 0,1375 (mol)
2) Dạng 2: H+ tác dụng với AlO2- hay
♦ Biết số mol Al(OH)3 , số mol
- Nếu nAl(OH)3 = n
- Nếu nAl(OH)3
◊ TH1: Chưa có hiện tượng hòa tan kết tủa hay
◊ TH2: Có hiện tượng hòa tan kết tủa hay
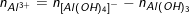
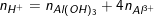
(Từ
Ví dụ: Cho 1 lít dung dịch HCl tác dụng với 500ml dung dịch hỗn hợp NaOH 1M và NaAlO2 1,5M thu được 31,2g kết tủa. Tính nồng độ CM của dung dịch HCl?
* Lời giải:
- Do có tạo kêt tủa Al(OH)3 nên OH- đã phản ứng hết.
- Theo bài ra, nOH- = 0,5.1 = 0,5 (mol). ⇒ nH+ pư = nOH- = 0,5 (mol).
nAlO2- = 0,5.1,5 = 0,75 (mol) ⇒ n
- Cũng theo bài ra: nAl(OH)3 = 31,2/78 = 0,4 (mol).
- Ta thấy: nAl(OH)3 AlO2- nên có 2 trường hợp xảy ra:
+) TH1:
- Khi đó: nH+ = nAl(OH)3 = 0,4 (mol).
⇒ ∑nH+ = 0,5 + 0,4 = 0,9 (mol).
⇒ CM (HCl) = n.V = 0,9.1 = 0,9 (M).
+) TH2:
- Khi đó sản phẩm có: nAl(OH)3 = 31,2/78 = 0,4 (mol).
⇒ nAl3+ = 0,75 - 0,4 = 0,35 (mol).
⇒ nH+ = nAl(OH)3 + 4nAl3+ = 0,4 + 4.0,35 = 1,8 (mol).
⇒ ∑nH+ = 0,5 + 1,8 = 2,3 (mol).
⇒ CM (HCl) = n.V = 2,3.1 = 2,3 (M).
3) Dạng 3: Hỗn hợp kim loại của nhôm với kim loại kiềm (Na, K,...) hay kiềm thổ (Ba, Ca,..)
- Lưu ý thứ tự của phản ứng:
Trước tiên: 2M kim loại kiềm + 2H2O → 2MOH + H2↑
Sau đó: MOH + H2O + Al → MAlO2 + 3⁄2H2↑
- Từ số mol của M cũng là số mol của MOH và số mol của Al ta biện luận theo PTPƯ để biết Al tan hết hay chưa.
◊ Nếu nM = nMOH ≥ nAl ⇒ Al tan hết
◊ Nếu nM = nMOH Al ⇒ Al chỉ tan một phần
◊ Nếu chưa biết số mol của M và Al và không có dữ liệu nào để khẳng định Al đã tan hết hay chưa thì ta phải xét 2 trường hợp:
◊ Dư NaOH nên Al tan hết
◊ Thiếu NaOH nên Al chỉ tan 1 phần
- Đối với mỗi trường hợp ta lập hệ phương trình đại số để giải.
- Nếu bài cho hỗn hợp Al với Ca hoặc Ba thì quy về hỗn hợp kim loại kiềm và Al bằng cách 1Ca hoặc 1Ba ⇔ 2Na rồi xét các trường hợp như trên.
Ví dụ: Hoà tan hỗn hợp X gồm Na và Al vào nước dư thu được V lít khí. Cũng hoà tan m gam hỗn hợp X trên vào dung dịch NaOH dư thì thu được - V lít khí. Tính %m mỗi kim loại trong hỗn hợp ban đầu.
* Lời giải
- Khi hòa hỗn hợp X và dd NaOH dư thì thu được thể tích khí lớn hơn khi hòa tan hỗn hợp X vào nước, như vậy khi hòa tan vào nước Al còn dư.
- Đặt V = 4.22,4 (lít). (lưu ý ở cùng điều kiện nhiệt độ và áp suất thể tích chính là số mol)
- Gọi x, y lần lượt là số mol của Na và Al
- Khi hòa tan vào nước ta có PTPƯ:
Na + H2O → NaOH + ½H2↑
x mol x 0,5.x
NaOH + Al + H2O → NaAlO2 + 3/2H2↑
x mol 1,5.x
⇒ ∑nH2 = 0,5x + 1,5x = 2x = 4 ⇒ x = 2.
- Khi hòa tan vào dung dịch NaOH dư ta có
Na + H2O → NaOH + ½H2↑
x mol x 0,5.x
NaOH + Al + H2O → NaAlO2 + 3/2H2↑
y mol 1,5.y
- Ta có: ∑nH2 = 0,5x + 1,5y = 7, mà x = 2 ⇒ y = 4
⇒ Hỗn hợp X có 2mol Na và 4mol Al
⇒ mNa = 2.23 = 46(g); mAl = 4.27 = 108(g)
⇒ %mNa =
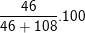
⇒ %mAl =
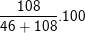
IV. Bài tập về Nhôm, hỗn hợp và hợp chất của nhôm
- Các em tự luyện tập
Bài 1: Hòa tan hoàn toàn 20,7 gam hỗn hợp X gồm Al và Al2O3 bằng lượng dung dịch NaOH 1M (vừa đủ). Sau phản ứng thu được 6,72 lít H2 (ở đktc). Tính thể tích dung dịch NaOH đã dùng?
Đ/S: Vdd (NaOH) = 500 (ml).
Bài 2: Đốt một lượng Al trong 6,72 lít O2. Chất rắn thu được sau phản ứng cho hòa tan hoàn toàn vào dung dịch HCl thấy thoát ra 6,72 lít H2 ( các thể tích khí đo ở đktc). Tính khối lượng Al đã dùng?
Đ/S: 16,2 (gam).
Bài 3: Cho 5,1 gam hỗn hợp X gồm Al và Mg tác dụng vừa đủ với dung dịch HCl thấy khối lượng dung dịch tăng lên 4,6 gam. Tính số mol HCl tham gia phản ứng?
Đ/S: nHCl=0,5 mol
Bài 4: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl (dư), sau khi kết thúc phản ứng sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư axit nitric (đặc, nguội), sau khi kết thúc phản ứng sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
Đ/S: m=12,3 ((gam).
Bài 5: Hoà tan m gam hỗn hợp bột Mg, Al bằng dung dịch HCl thu được 17,92 lit khí H2 (đktc). Cùng lượng hỗn hợp trên hoà tan trong dung dịch NaOH dư thu được 13,44 lít khí H2 (đktc). Tính m?
Đ/S: m=15,6 (gam).
Bài 6: Thêm 0,35 mol NaOH vào dung dịch X chứa 0,1 mol AlCl3. Tính khối lượng kết tủa thu được?
Đ/S: mAl(OH)3 = 3,9 (gam).
Bài 7: Thêm 200 ml dung dịch A chứa NaOH 0,3M và Ba(OH)2 0,025M vào 200 ml dung dịch Al(NO3)3 0,1M thu được kết tủa B. Lọc, tách B rồi đem nung trong không khí đến khối lượng không đổi thì thu được m gam chất rắn D. Tính m?
Đ/S: m=0,51 (gam).
Bài 8: Cho 150 ml dung dịch Ba(OH)2 0,1M tác dụng với 100 ml dung dịch Al2(SO4)3 0,1M. Tính khối lượng kết tủa tạo thành sau phản ứng?
Đ/S: mAl(OH)3 = 4,275 (gam).
Bài 9: Cho 200 ml dung dịch X chứa Ba(OH)2 0,1M và KOH 0,15M vào 100 ml dung dịch Al2(SO4)3 0,1M. Sau phản ứng thu được m gam kết tủa. Tính giá trị của m?
Đ/S: m = 5,44 (gam).
Bài 10: Một dung dịch chứa hỗn hợp gồm 0,02 mol Al2(SO4)3 và 0,02 mol Na2SO4. Thêm dung dịch chứa 0,07 mol Ba(OH)2 vào dung dịch này. Tính khối lượng kết tủa sinh ra?
Đ/S: m = 17,87 (gam).
Bài 11: Cho 3,42 gam Al2(SO4)3 tác dụng với 25 ml dung dịch NaOH. Sau phản ứng thu được 0,78 gam kết tủa. Tính nồng độ của dung NaOH đã dùng?
Đ/S: 1,2M và 2,8M
Bài 12: Cho 200 ml dung dịch NaOH a mol/lít tác dụng với 500 mL dung dịch AlCl3 0,2M thu được một kết tủa keo trắng. Lọc tách kết tủa, đem nung trong không khí đến khối lượng không đổi thì thu được 1,02 gam chất rắn. Tính a?
Đ/S: 0,3 và 1,9
Bài 13: Thêm V lít dung dịch NaOH 0,1M vào 100 mL dung dịch Al2(SO4)3 0,1M thấy xuất hiện 1,17 gam kết tủa keo trắng. Tính giá trị nhỏ nhất của V?
Đ/S: 0,45 (lit)
Bài 14: Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Tính giá trị lớn nhất của V ?
Đ/S:0,45 (lit)
Bài 15: Hòa tan 0,54 gam Al trong 0,5 lít dung dịch H2SO4 0,1M được dung dịch A. Thêm V lít dung dịch NaOH 0,1M cho đến khi kết tủa tan trở lại 1 phần. Nung kết tủa thu được đến khối lượng không đổi ta được chất rắn nặng 0,51 gam. Tính V?
Đ/S: 1,1 lít.
Bài 16: Hoà tan hoàn toàn m gam hỗn hợp X gồm Na2O và Al2O3 vào H2O thu được 200 ml dung dịch Y chỉ chứa chất tan duy nhất có nồng độ 0,5M. Thổi khí CO2 (dư) vào Y thu được a gam kết tủa. Tính m và a?
Đ/S: m=8,2 và a=7,8
Bài 17: Sục khí CO2 vào dung dịch chứa NaAlO2, sau khi phản ứng kết thúc thu được m gam kết tủa và khối lượng dung dịch giảm 4,42 gam. Tính m?
Đ/S: 10,14 gam.
Bài 18: Thêm HCl vào dung dịch chứa 0,1 mol NaOH và 0,1 mol Na
Đ/S: 0,18 mol hoặc 0,26 mol
Bài 19: Hòa tan 3,9 gam Al(OH)3 bằng 50ml NaOH 3M được dung dịch A. Thể tích dung dịch (lít) HCl 2M cần cho vào dung dịch A để xuất hiện trở lại 1,56 gam kết tủa là bao nhiêu?
Đ/S: 0,06 hoặc 0,12
Bài 20: Cho 100 ml dung dịch A chứa NaOH 0,1M và NaAlO2 0,3M. Thêm từ từ dung dịch HCl 0,1M vào dung dịch A cho đến khi kết tủa tan trở lại một phần. Đem nung kết tủa đến khối lượng không đổi thu được chất rắn nặng 1,02 gam. Tính thể tích dung dịch HCl 0,1M đã dùng?









